همه جهان هستی از اتم و ساختارهای اتمی ساخته شده اند که تمام این بلوک های ساخته شده از جدولی به نام جدول تناوبی و یا جدول مندلیف سر چشمه گرفته اند. به طور کلی این جدول اطلاعات زیادی از ماهیت، رفتار و ویژگی عناصرهای مختلف را در اختیار ما قرار می دهد که ممکن است مطالعه و حفظ کردن آن برای برخی از افراد سخت به نظر برسد. اما واقعیت این است که با درک مفهوم اصل جدول تناوبی لذت خواندن شیمی و حل مسائل مربوط به این زمینه برای شما دوچندان خواهد شد! پس بیایید وقت را تلف نکنیم و همین الان شروع به خواندن این جدول علمی کنیم.
تاریخچه جدول مندلیف
اگر به سفر کوتاهی در قرن 19 برویم، می توان دریافت که برای اولین بار جدول تناوبی از طرف دانشمند و شیمیدانی روسی به نام دیمیتری مندلیف تنظیم گردید. این جدول بر اساس ادعایی که مندلیف داشت از قوانین خاصی تبعیت می کرد، اما بعدها مشخص شد که خود مندلیف بر قوانینی که ایجاد کرده است پایبند نبوده و شکاف هایی در این جدول دیده می شود. بنابراین این موضوع موجب شد تا این جدول در سال های متمادی تا به امروز دستخوش تغییراتی شده و جدول امروزی به وجود آید.

مفاهیم پایه ای برای دریافت اطلاعات از جدول تناوبی
برای درک هرچه بهتر جدول تناوبی مندلیف باید ابتدا مفاهیم زیر را مطالعه کرده و سپس اقدام به حفظ کردن آن کنید تا در مسائل شیمی به مشکل برنخورید:
عدد اتمی به مجموع تعداد پروتون های هسته یک عنصر گفته می شود که با توجه به قوانین موجود در عناصر، در حالت خنثی عدد تعداد پروتون (عدد اتمی) هر عنصر برابر با تعداد الکترون آن می باشد.
همان طور که می دانید الکترون وزن چندانی ندارد و وزن اتم به پروتون و نوترون وابسته است. بنابراین برای مشخص کردن وزن اتم می توان از عدد جرمی مجموع نوترون و پروتون استفاده کرد.
نماد شیمیایی به نماد اختصاری (انگلیسی) گفته می شود که به عنوان یک قانون در تمام جدول ها یکسان بوده و معرف آن عنصر می باشد.
مثال! برای مثال می توانید به تصویر زیر توجه کنید که در آن Na نماد شیمیایی عنصر، عدد 22.9897 عدد جرمی (پروتون + نوترون)، عدد 11 نمایش دهنده تعداد پروتون و یا عدد اتمی است که در صورت خنثی بودن برابر با تعداد الکترون نیز می باشد.
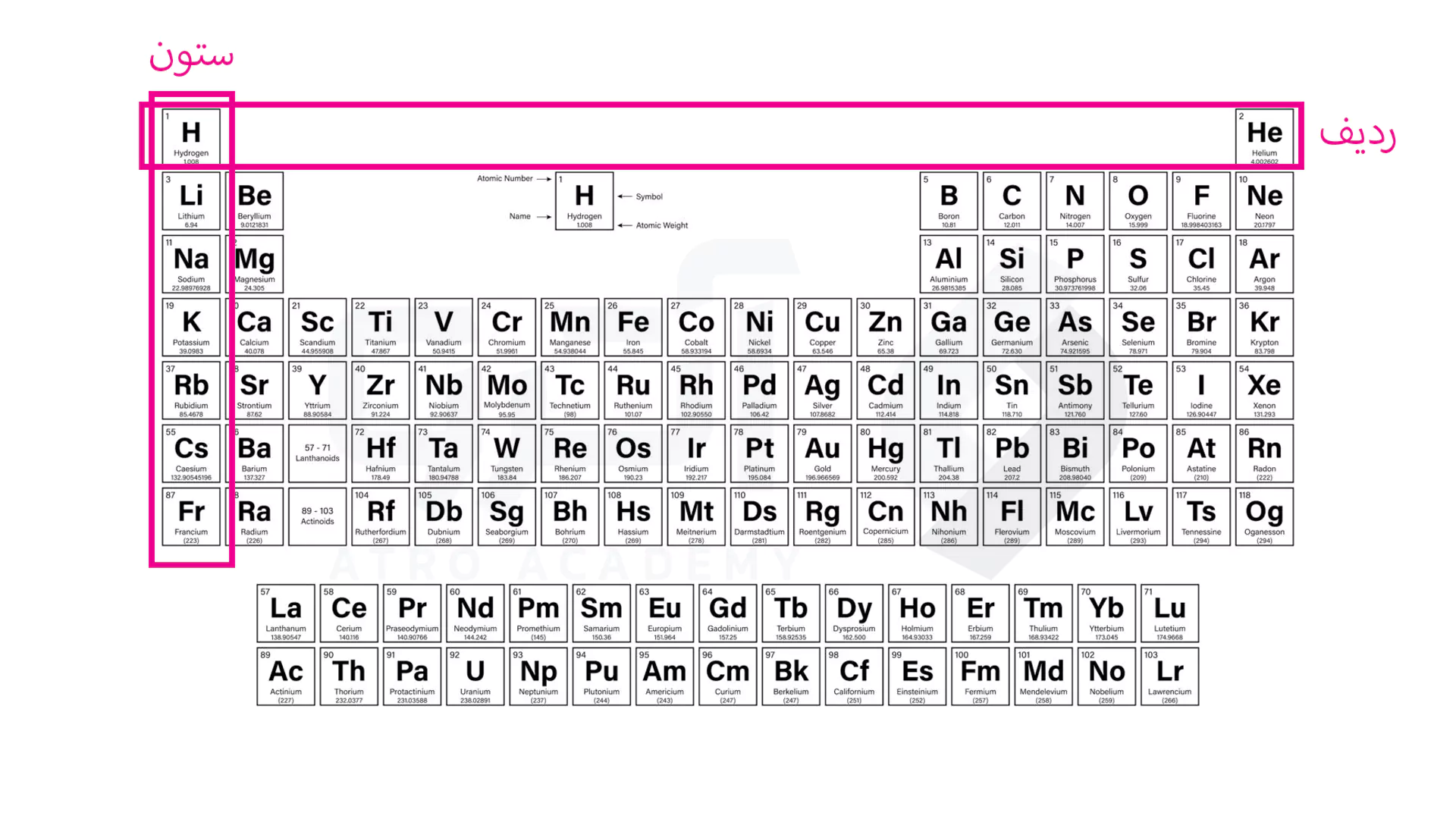
جدول تناوبی 18 ستون دارد که هرکدام از آن ها یک گروه نامیده شده و شامل عناصری است که خواص و ویژگی های مشابه ای دارند. اما بعدها قانون مورد استفاده در این گروه بندی ها آرایش الکترونی در لایه ظرفیت هر عنصر در نظر گرفته شد.
ردیف، دوره و یا تناوب به عنوان دسته بندی های افقی (7 ردیف وجود دارد) هستند که به ترتیب از چپ به راست با افزایش عدد اتمی تنظیم شده است. به گونه ای که هر عنصر نسبت به عنصر قبلی یک پروتون و یک الکترون اضافه داشته و طبق آزمایشات با حرکت از چپ به راست خاصیت فلزی کمتر و مقدار الکترونگاتیوی بیشتری خواهند داشت.
قانون این جدول بر اساس افزایش عدد اتمی است و با در نظر گرفتن بالا و پایین شدن برخی خاصیت ها و وجود استثناها ثابت شده است که با حرکت از کم ترین تا بیشترین اعداد اتمی خاصیت ها به طور تناوبی تغییر خواهند کرد.
حقایق جالب در جدول مندلیف امروزی
- این جدول در قرن 19 ایجاد شد ولی از آن زمان مندلیف عناصر کشف نشده را همراه با خواص آن ها پیش بینی کرد.
- جدول مندلیف بر اساس افزایش مقدار وزن اتمی تنظیم شده است نه عدد اتمی!
- هنوز هم با گذشت سال ها عناصری وجود دارد که کشف نشده اند.
- مندلیف دو جای خالی قرار داد و عناصر گالیوم و ژرمانیم را پیش بینی کرد.
- تمام خصوصیات شیمیایی عناصر در جدول مندلیف به صورت تناوبی تکرار می شوند.
- عناصر با توجه به خواص فیزیکی و شیمیایی ترتیب بندی خاصی دارند.
- جدول مندلیف به عنوان یک ابزار آموزشی و نقطه عطف در تاریخ شیمی شناخته می شود.
- نام عناصر توسط سازمانی به نام (IUPAC) پیشنهاد شده و توسط دانشمندان بررسی و تایید می گردد.
- در نامگذاری عناصر به عوامل مختلفی مانند طولانی ترین زنجیر کربنی به عنوان زنجیر اصلی توجه می شود.
با خواندن جدول مندلیف چه اطلاعاتی می توان بدست آورد؟
برای آسان تر شدن نحوه مطالعه و بررسی در ادامه به صورت ستون به ستون تمام 18 گروه را همراه با ویژگی های خاصی که دارند بررسی خواهد شد:
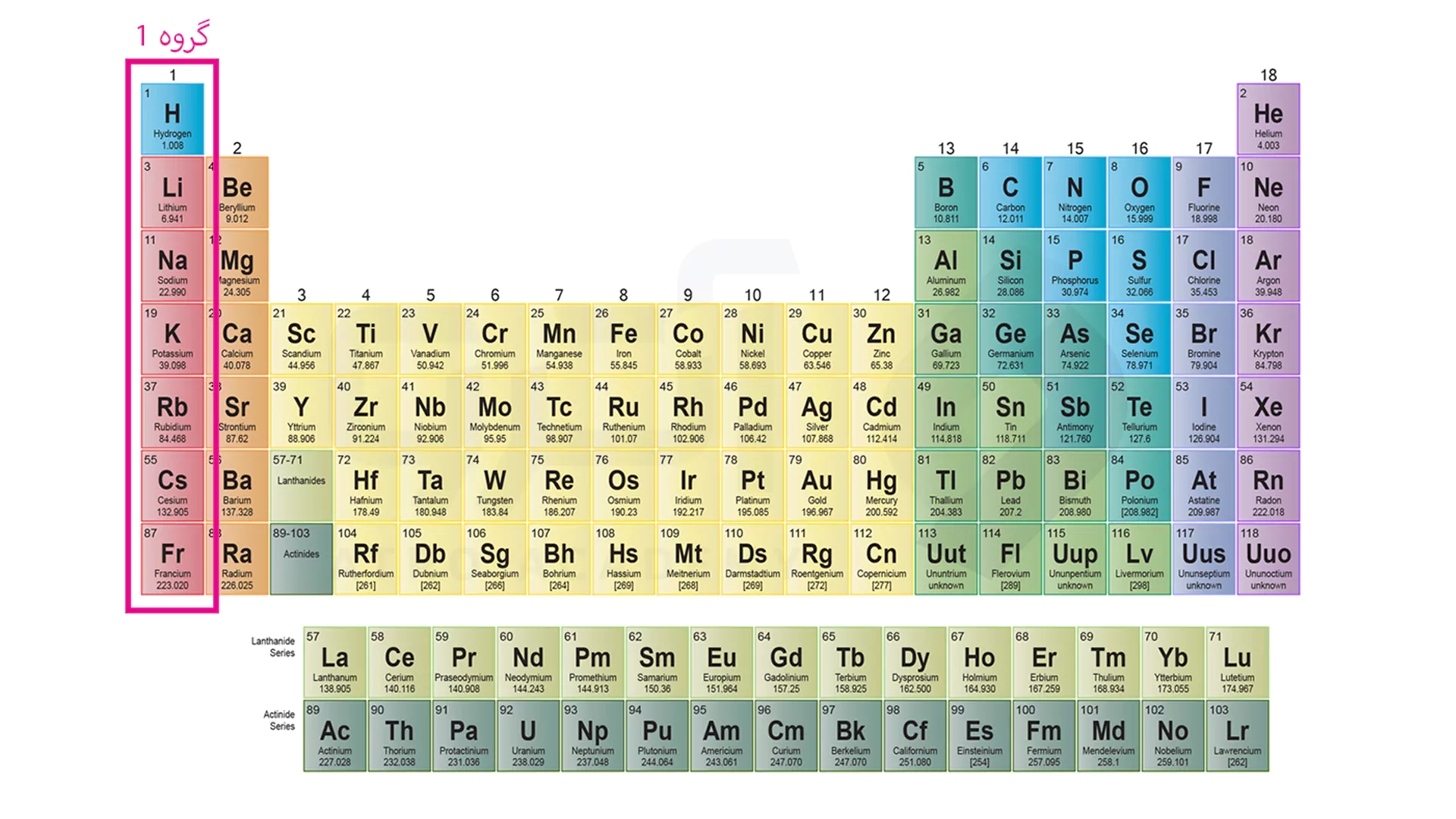
گروه اول در جدول به
فلزات قلیایی معروف هستند که شامل عناصر هیدروژن (استثناً فلز نیست)، لیتیوم، سدیم، پتاسیم، روبیدیوم، سیسیوم و فرانسیوم می باشد. این دسته فلزات نرم بوده و از چگالی (جرم نسبت به حجم) پایینی برخوردار هستند. همچنین نقطه ذوب، نقطه جوش، ذوب و تبخیر پایینی داشته و به دلیل داشتن یک الکترون ناپایدار در لایه آخر (لایه ظرفیت) آماده از دست دادن الکترون خود هستند. این قابلیت واکنش از بالا به پایین بیشتر می شود زیرا لایه ها بیشتر شده و تاثیر جذب هسته بر الکترون آخر (بار موثر هسته) کاهش پیدا می کند و به راحتی الکترون از دست می دهد.
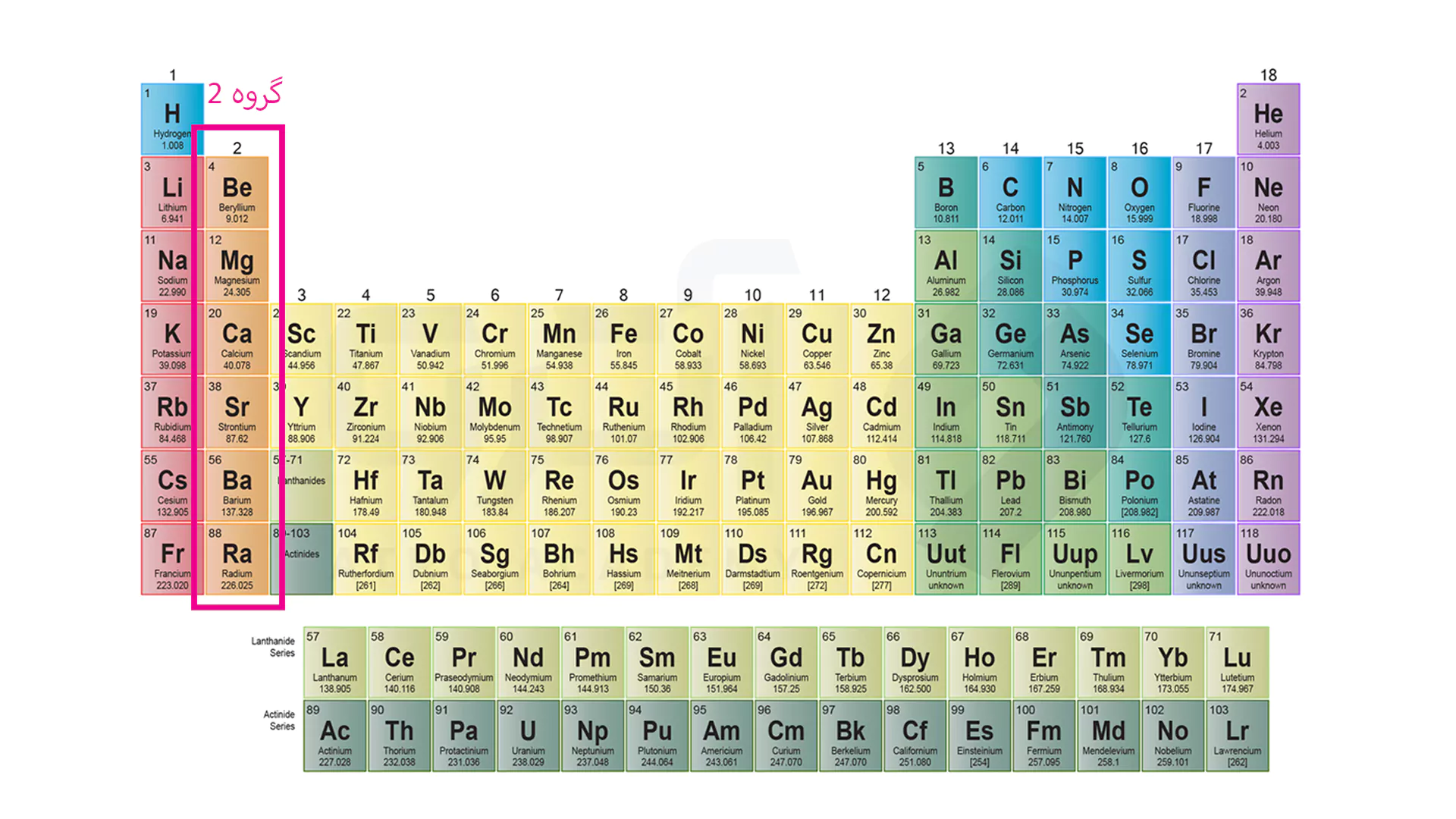
این گروه
فلزات قلیایی خاکی نامیده می شوند و شامل عناصری مانند برلیوم، منیزیوم، کلسیوم، استرنیوم، باریم و رادیوم است. این گروه از فلزات به دلیل بار موثر بالاتر در الکترون آخر نسبت به گروه 1 واکنش پذیری کمتری دارند و از بالا به پایین با افزایش لایه های الکترون، ویژگی واکنش پذیری بیشتر خواهد شد. همچنین لازم به ذکر است که عنصر رادیوم در آخر گروه یک عنصر رادیواکتو می باشد.
این عناصر واسطه همگی فلز هستند و به عنوان فلزات واسطه شناخته می شوند. این فلزات نرم بوده و خاصیت انعطاف پذیری زیادی دارند. همچنین لازم به یادآوری است که جیوه تنها فلز مایع در این دسته بندی می باشد و استثناء فلزات روی، کادمیم و جیوه بقیه موارد نقطه ذوب و جوش و مقدار چگالی بالایی را دارند.
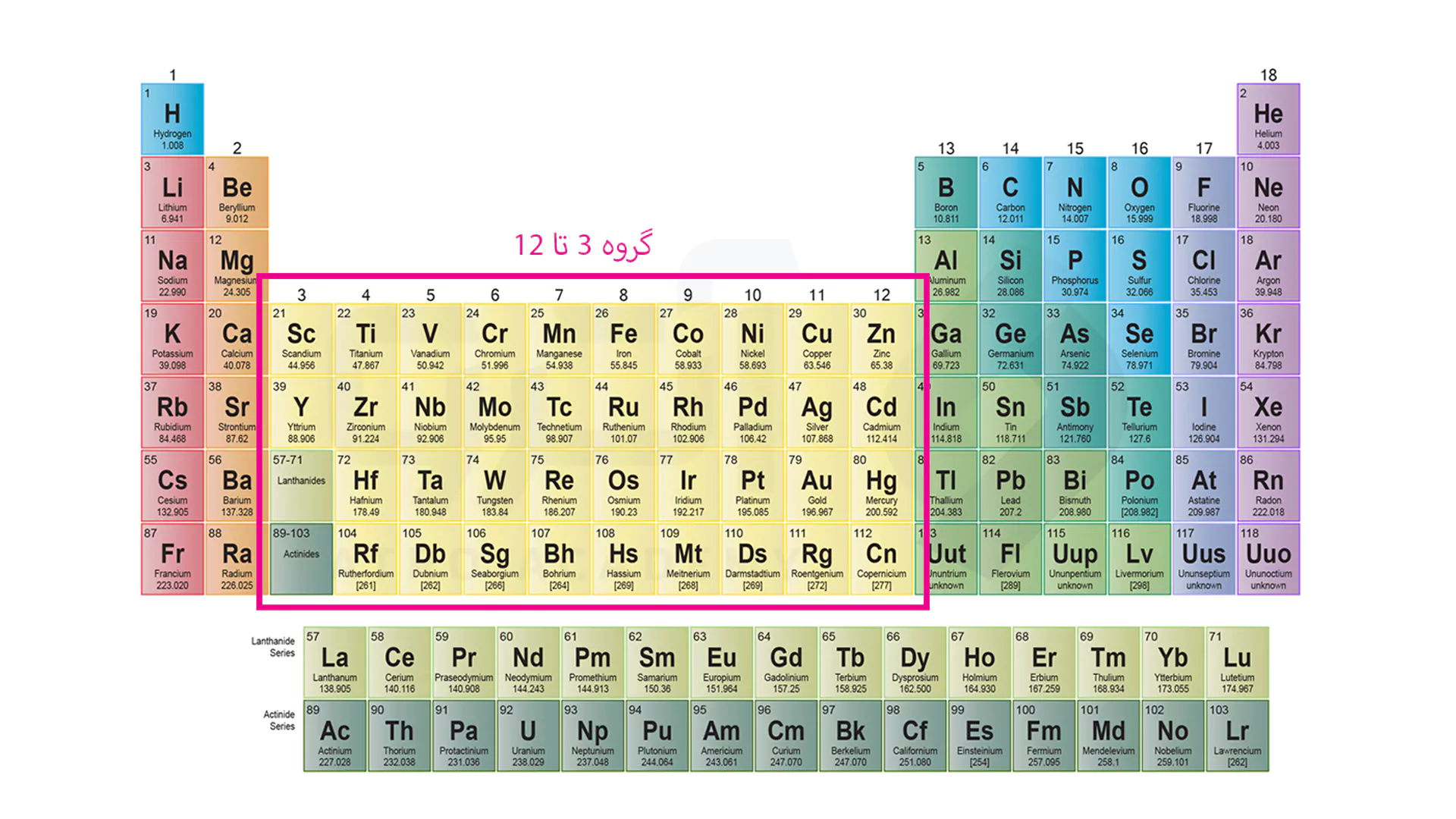
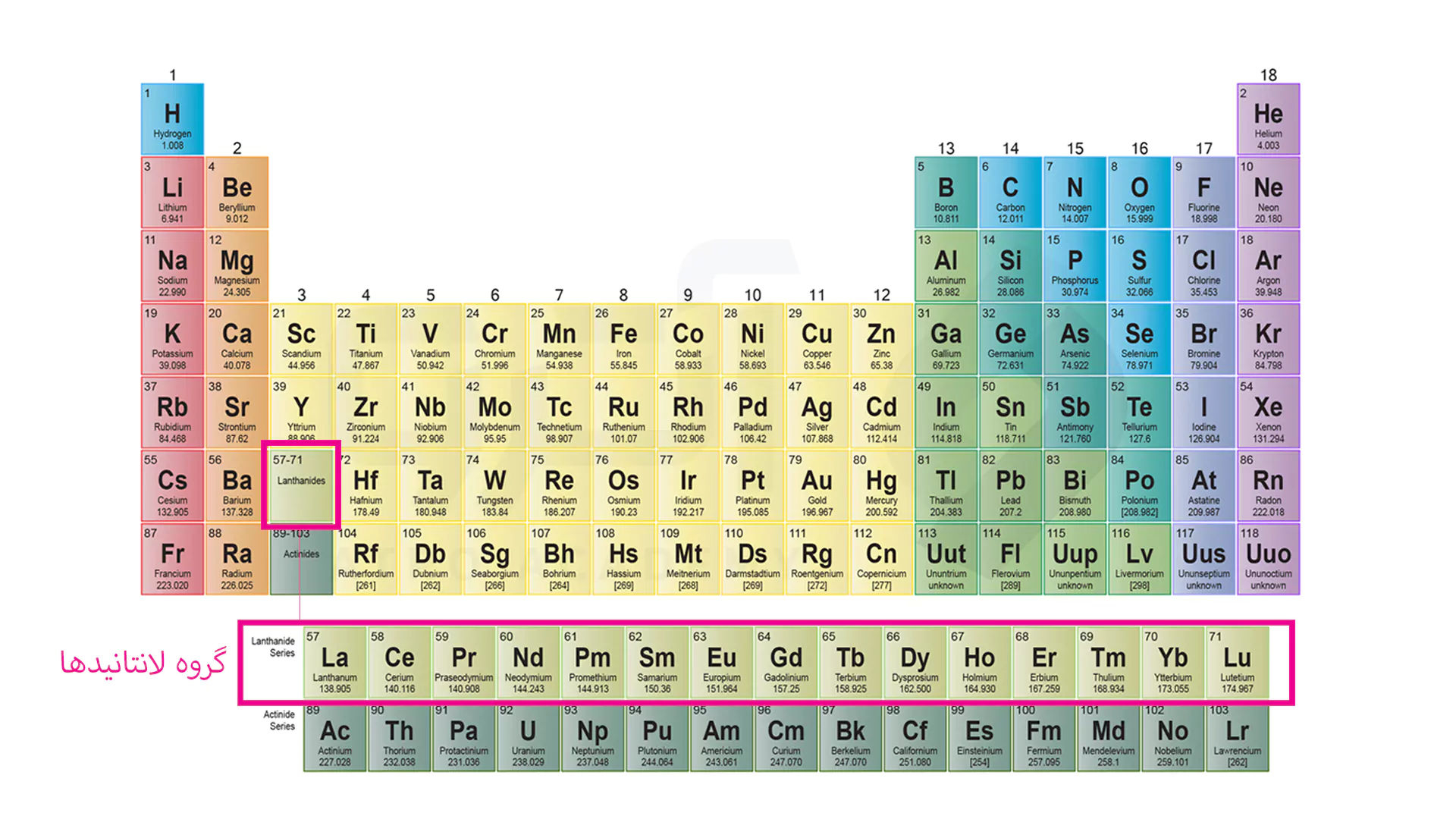
همان طور که مشاهده می کنید دو ردیف مجزا وجود دارد که داستان این ردیف ها جدا از عناصر دیگر است. ردیف اول لانتانیدها نامیده می شوند و شامل عناصری است که باید در خانه لانتان که مشخص شده است، قرار می گرفت. در لانتانیدها عناصر اوربیتال f4 در حال پر شدن است و خاصیت پارا مغناطیسی دارند.
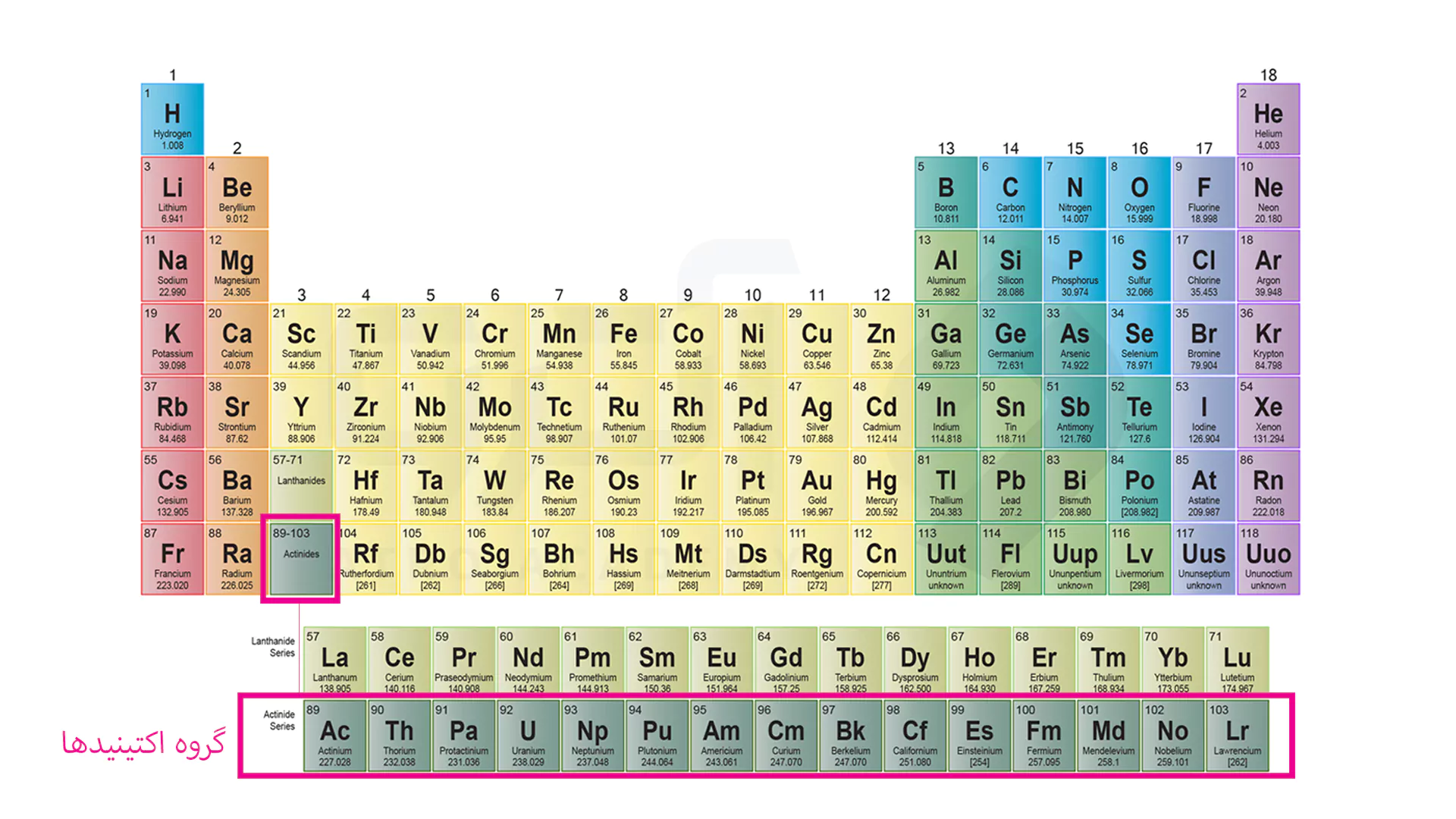
گروه بعدی که در خانه اکتینید قرار گرفته اند همگی اکتینید نامیده شده و دارای خاصیت رادیواکتیوی هستند. همچنین تحقیقات نشان داده است در این عناصر لایه f5 در حال پر شدن است.
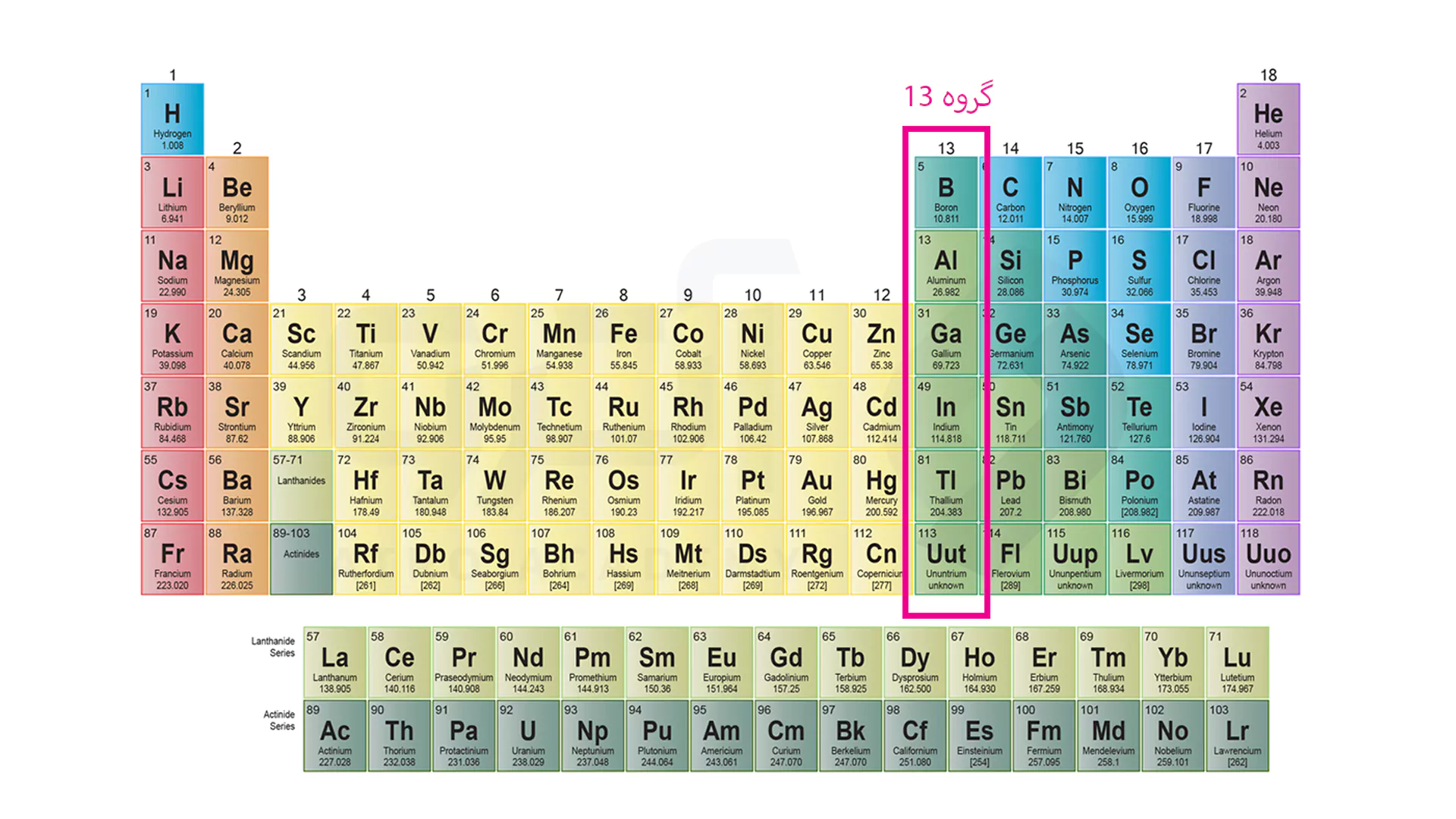
این گروه به خانواده بور معروف شده و عناصری مانند بور، آلومینیوم، گالیم، ایندیم و تالیم را دارند که فعالیت زیادی با یون های هالید نشان می دهند. این خانواده با 3 الکترون موجود در لایه ظرفیت خود ترکیبات آلی زیادی را ایجاد می کنند که از شگفتی های این گروه شمرده می شود.
عناصر کربن، سیلیسیم، ژرمانیوم، قلع و سرب گروه 14 را به نام خانواده کربن ها ایجاد کرده اند که در لایه ظرفیت آن ها 4 الکترون وجود دارد. در واقع این گروه را می توان مرزی بین فلزات (سمت چپ جدول) و نافلزات (سمت راست) شمرد و کربن را از معروف ترین و محبوب ترین عنصرهای این گروه دانست.
اکنون به جمع عناصر نیتروژن، فسفر، ارسنیک، آنتیموان و بیسموت رسیده ایم که تشکیل شده از انواع فلز، شبه فلز و یا نافلز هستند. همچنین با داشتن 5 الکترون در لایه ظرفیتی خود از مهم ترین عناصر در طبیعت و داخل حیات زندگی انسان و حیوانات شمرده می شوند.
گروه 16 مخصوص گروه اکسیژن ها و یا کالکوژن است که عناصری مانند اکسیژن، گوگرد، سلنیوم، تلور و پولونیوم دارد و از معروف ترین آن ها به طبع اکسیژن و گوگرد می باشد. اما برخلاف این موضوع عنصری مانند پولونیوم وجود دارد که بسیار سمی و مضر است.
یکی دیگر از دسته بندی های جدول تناوبی گروه هالوژن ها است که در ستون 17 این جدول قرار گرفته اند. این دسته از عناصر هیچگاه به صورت مستقل و آزاد در طبیعت وجود ندارند و به دلیل ناپایداری خود همواره به طور موکلول های دو اتمی یافته می شوند. طبق آزمایشات انجام شده این عناصر تمایل زیادی به پذیرش یک الکترون در آخرین لایه خود دارند تا به آرایش اوکتت (آرایش گازهای نجیب که 8 الکترون در آخرین لایه دارند) برسند.
و اما آخرین ستون از جدول های تناوبی مربوط به گازهای نجیب می باشد که به صورت پایدار قرار گرفته اند و می توان گفت تقریباً هیچ تمایلی به برقراری ارتباط با سایر عناصر ندارد. این موضوع واکنش ناپذیری در گازهای نجیب به دلیل پایداری در آخرین لایه آن ها می باشد که 8 لایه الکترون در آخرین لایه وجود دارد. به همین دلیل می توان گفت که به این ستون گروه گازهای بی اثر نیز گفته می شود. علاوه بر این موارد لازم به ذکر است که دو گاز رادون و اوگانسون از خاصیت رادیواکتیوی برخوردار هستند.
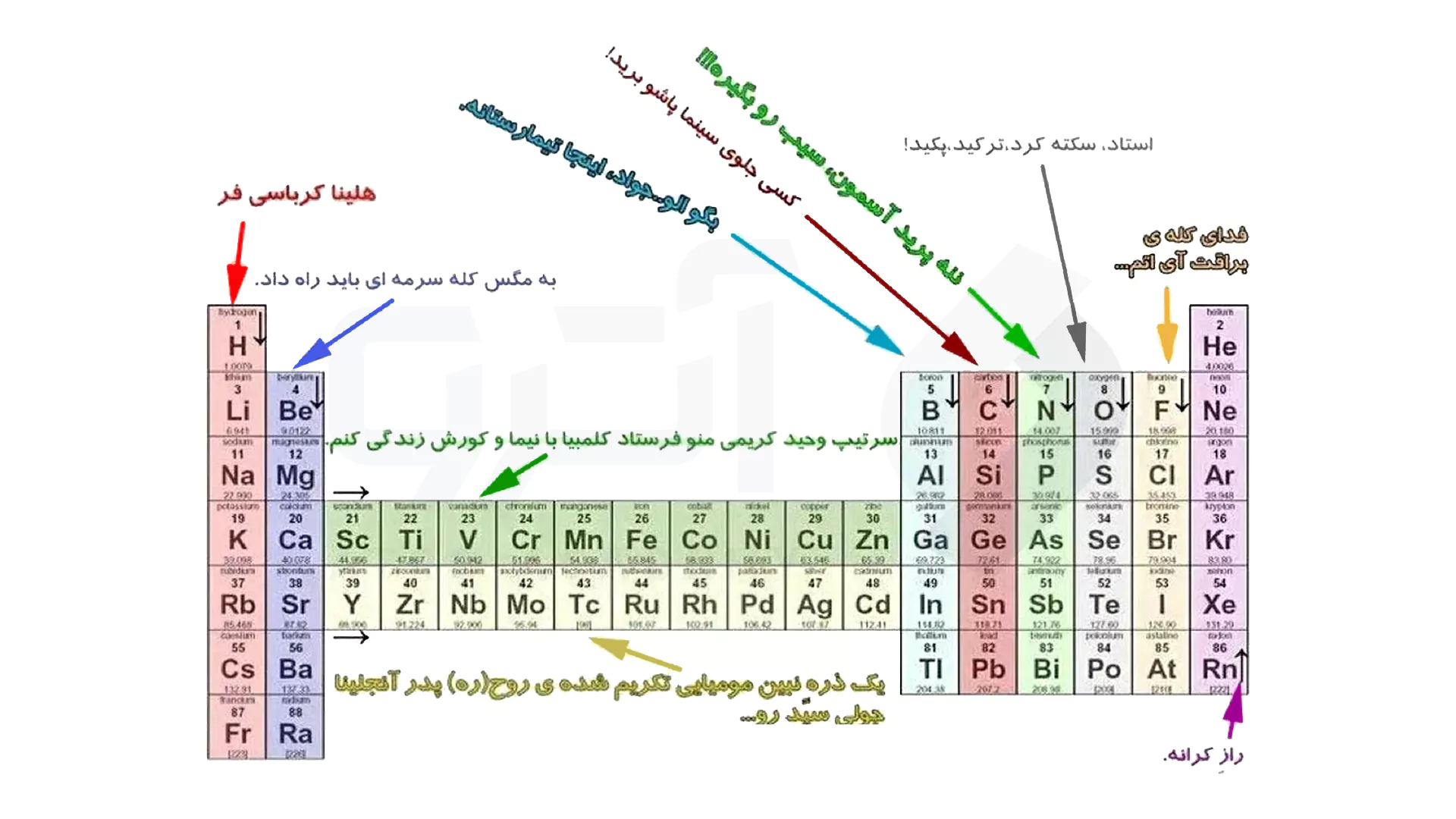
بهترین روش حفظ کردن جدول تناوبی در شیمی
بسیار مهم است که برای بهتر و سریع تر ل کردن مسائل سخت در شیمی، از حفظ کردن این جدول کمک بگیرید، زیرا این یک واقعیت است که چاره دیگری برای این کار وجود ندارد! اما جالب است که بسیاری از اساتید خوش ذوق و علقه مند به شیمی به مرور زمان از رمز و رازهای استفاده کرده اند که کار حفظ این جدول را بسیار آسان تر خواهد کرد. اما توجه داشته باشید که این رمزها برای هر فرد تغییر می کند و حتی توصیه می کنیم از اصطلاحات خودتا در رمزگذاری استفاده کنید تا به خاطر سپردن آن آسان تر باشد.
خلاصه ای از مهم ترین نکات جدول مندلیف در قالب جدول!
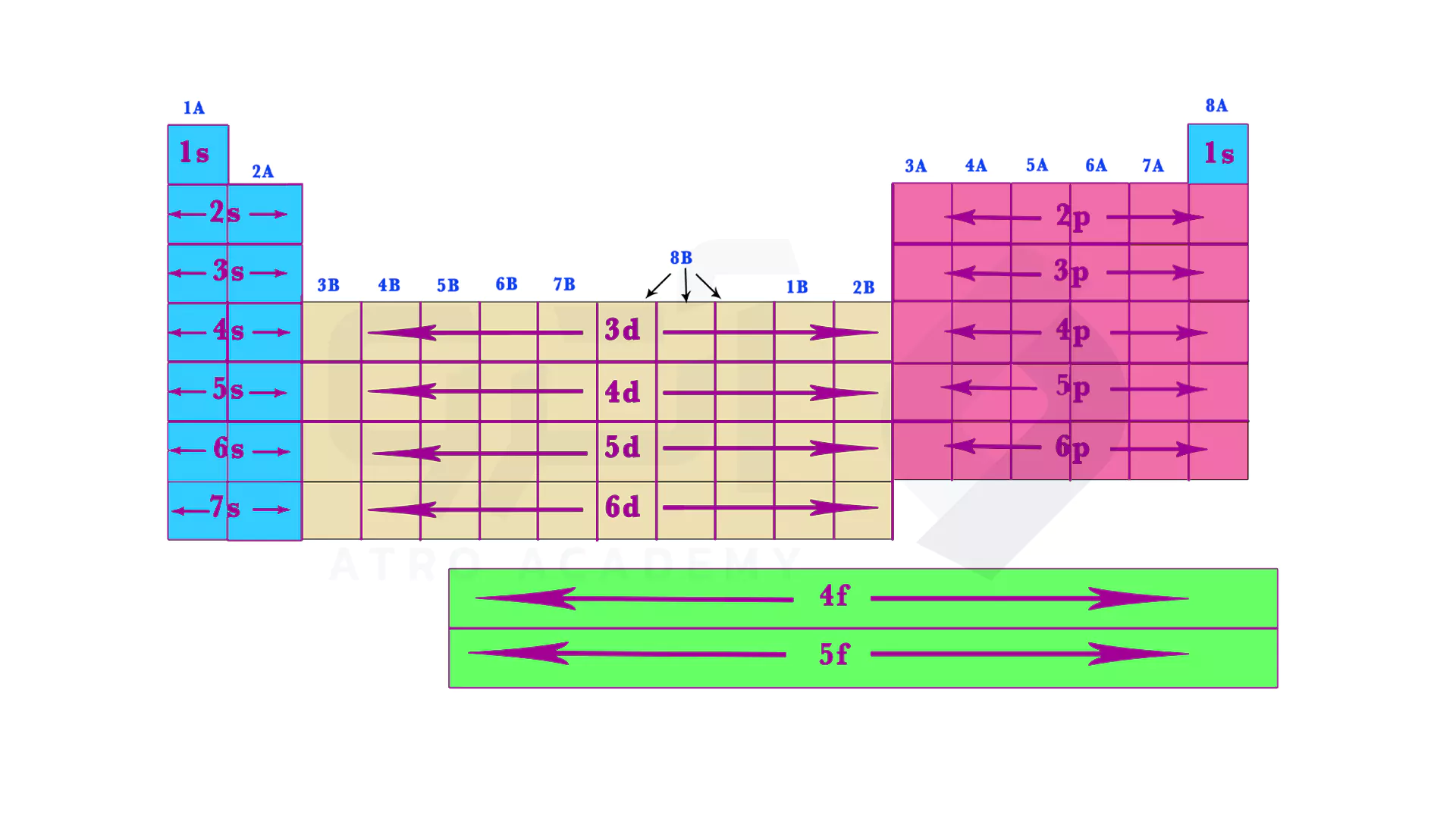
برای پاسخ دادن به این سوا که " در هر یک از ردیف های جدول مندلیف کدام لایه در حال پر شدن است؟ " می توانید به جدول زیر توجه کنید.
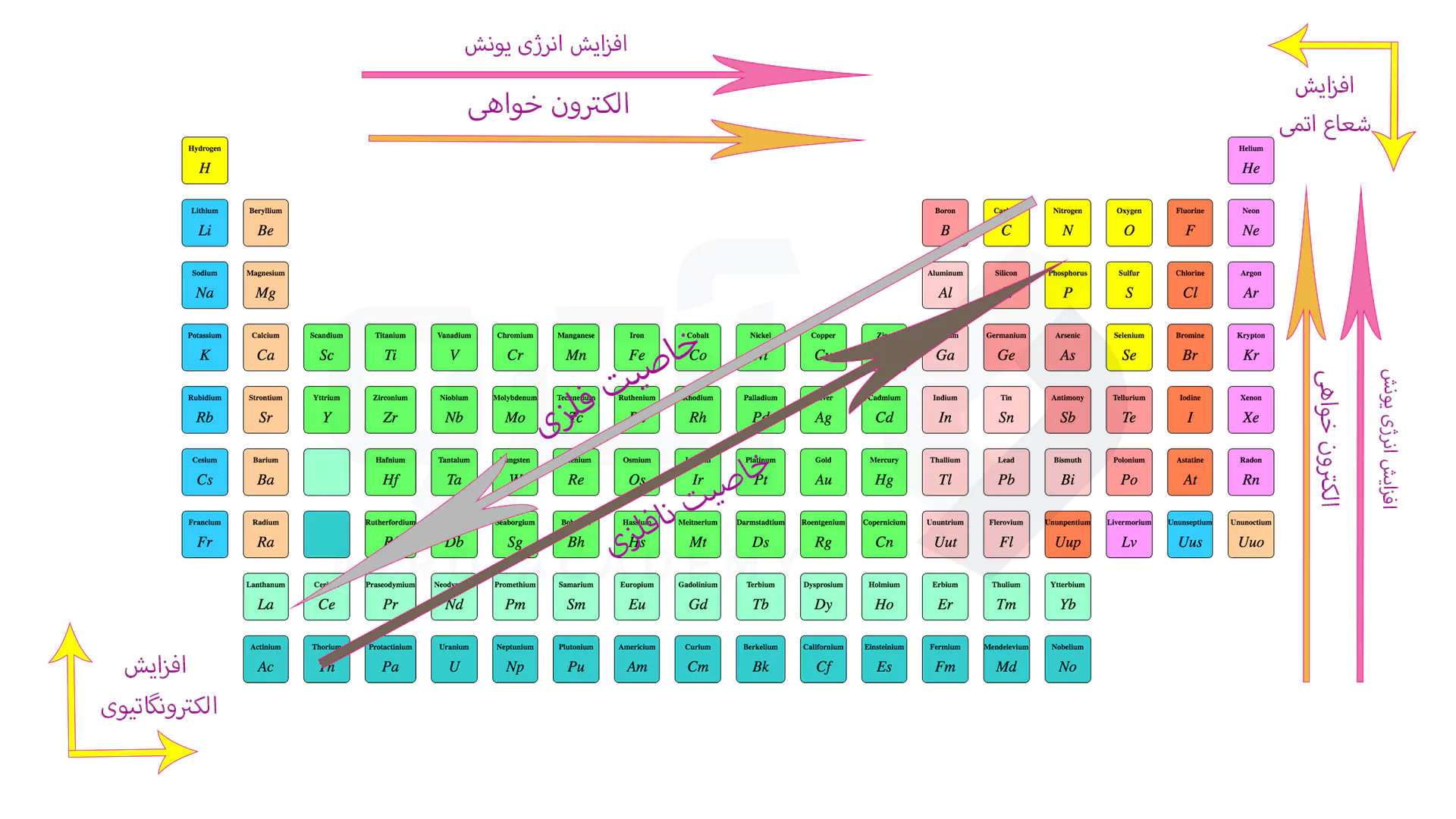
همچنین می توانید با توجه کردن به جدول زیر از روند تغییرات کلی در جدول مندلیف به صورت کامل باخبر باشید.
در پایان توصیه می کنیم یک جدول خالی به صورت زیر داشته باشید و آموخته های خود از این آموز را چندین و چند بار مطالعه و تکرار کنید.
سخن آخر
در این بلاگ آموزشی از حوزه شیمی سعی بر این داشتیم تا شما را با یکی از چالش های سخت مسائل شیمی مواجه کرده و این مشکل را برای شما برطرف کنیم. بنابراین امیدواریم با خواندن و تمرین و تکرار این موارد بتوانید راز و رمزهای جدول تناوبی را به صورت دقیق دریابید. از همراهی شما ممنونیم و برای تان آرزوی موفقیت همیشگی داریم.
























